Разрушение коленных хрящевых тканей может происходить в силу разных причин. В пожилом возрасте это обуславливается недостаточной выработкой ходроцитов и коллагена, которые являются составными частями гиалинового хряща. Молодые люди страдают от подобной проблемы вследствие травм – ушибов, падений, чрезмерных нагрузок. Однако наиболее частой причиной нарушения целостности хрящевых тканей являются патологии суставов.
В медицине восстановление хрящей колен выполняется консервативными методами. Они подразумевают терапию хондопротектерами, лечебную диету и комплекс упражнений. При отсутствии эффекта больному проводят хирургическую операцию, в процессе которой устанавливаются хрящевые трансплантаты.
Современная медицина предлагает несколько перспективных методов восстановления хрящевой ткани коленного сустава, включая регенеративную терапию стволовыми клетками, микрофрактурирование, аутологичную трансплантацию хондроцитов (ACI/MACI) и PRP-терапию. Эти подходы демонстрируют эффективность при локальных повреждениях хряща, обеспечивая снижение болевого синдрома на 75-80% случаев и анатомическое восстановление тканей в течение 4-6 месяцев. Однако при распространённом остеоартрозе методы носят паллиативный характер, требуя комбинации с другими видами лечения.
Анатомические и физиологические основы регенерации хряща
Структура гиалинового хряща
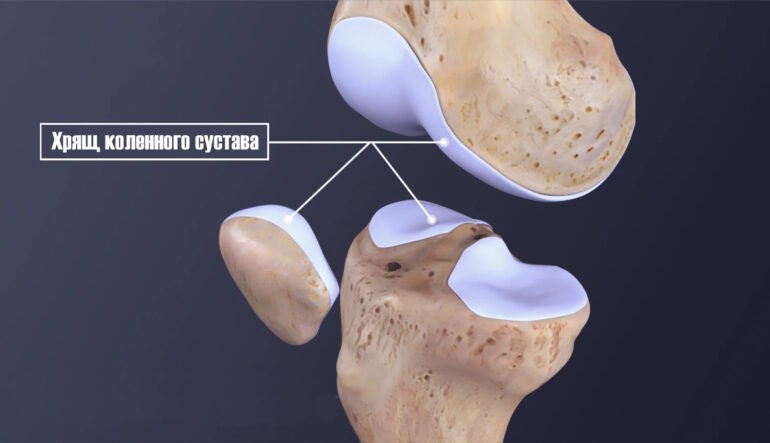
Гиалиновый хрящ коленного сустава представляет собой аваскулярную ткань толщиной 2-4 мм, состоящую из хондроцитов (5%), коллагена II типа (15-20%) и протеогликанов (75-80%). Отсутствие прямой васкуляризации ограничивает его репаративный потенциал, так как процессы заживления зависят от диффузии питательных веществ из синовиальной жидкости и субхондральной кости. Надхрящница, покрывающая суставные поверхности, содержит камбиальные клетки, способные к пролиферации, но их активность недостаточна для компенсации значительных дефектов.
Патогенез дегенеративных изменений
Механическое истирание хряща при остеоартрозе происходит при дисбалансе между анаболическими (IGF-1, TGF-β) и катаболическими (IL-1β, TNF-α) факторами. Потеря протеогликанов приводит к снижению упругости на 40-60%, увеличивая нагрузки на субхондральную кость и провоцируя образование остеофитов. Клинически это проявляется крепитацией, блокадами сустава и прогрессирующим ограничением движений.
Хирургические методы стимуляции регенерации
Микрофрактурирование (микротрещины)
Техника, разработанная в 1990-х годах, предполагает создание перфораций диаметром 2-3 мм в субхондральной кости через артроскопический доступ. Это вызывает миграцию мезенхимальных стволовых клеток из костного мозга, формирующих фиброзно-хрящевую ткань. По данным Steadman Clinic, у 75-80% пациентов отмечается значительное улучшение функции сустава в течение 6-8 недель, хотя образованная ткань имеет на 30% меньшую упругость по сравнению с исходным гиалиновым хрящом.
Аутологичная трансплантация хондроцитов (ACI/MACI)
Двухэтапная процедура включает артроскопический забор хрящевых клеток из ненагружаемых участков сустава с последующим 4-6-недельным культивированием in vitro. Вторым этапом выполняется имплантация клеточного матрикса в область дефекта. Технология MACI (Matrix-Induced Autologous Chondrocyte Implantation) с использованием коллагенового носителя позволяет достичь 85% заполнения дефекта гиалиноподобной тканью через 2 года. FDA одобрило метод в 2016 году для дефектов размером до 10 см².
Биологические методы регенерации
Терапия стволовыми клетками
Интраартикулярное введение мезенхимальных стволовых клеток, полученных из жировой ткани или костного мозга, стимулирует паракринные эффекты за счёт секреции IGF-1 и VEGF. Клинические исследования демонстрируют увеличение толщины хряща на 0,3-0,5 мм по данным МРТ через 6 месяцев. Однако метод требует точного подбора клеточной концентрации (оптимально 1×10⁶ клеток/мл) и комбинации с факторами роста.
PRP-терапия
Инъекции обогащённой тромбоцитами плазмы обеспечивают доставку PDGF (Platelet-Derived Growth Factor) и TGF-β, ускоряющих синтез коллагена. Протоколы с 3-5 инъекциями с интервалом 7 дней снижают болевой синдром по шкале VAS на 60% через 3 месяца. Эффективность выше при дефектах менее 2 см² и у пациентов моложе 50 лет.
Проведение консервативной терапии
Процессу восстановления хрящей предшествует тщательная диагностика. В ходе ее выявляются причины разрушений тканей. Для данных целей проводится рентгенография, по снимкам которой врач анализирует состояние больного. Наличие остеофитов подразумевает протекание гонартроза.
Эффективность лечения гонартроза обуславливается степенью тяжести болезни:
- первая и вторая степени – допускается частичная регенерация хряща;
- третья и четвертая стадии – показано проведение эндопротезирования.
Полностью восстановить коленный сустав не всегда реально. Однако при грамотном лечении и тщательном следовании рекомендаций врача можно добиться частичного восстановления. В комплекс терапии входит прием препаратов, ограничения физических нагрузок, выполнение определенных гимнастических упражнений. Также рекомендуется исключить употребление соленой и жирной пищи. Меню человека должно включать большое количество овощей и фруктов, крупяные каши и нежирные сорта мяса. Подобное питание обеспечит достаточную выработку синовиальной жидкости, снабжающей сустав всеми необходимыми веществами.
Какие препараты можно принимать
Единственными препаратами, способствующими регенерации хряща, являются хондопротекторы. Их назначают в реабилитационный период после травмирования либо после проведения хирургического вмешательства. Прием хондопротекторов осуществляется курсами с двухнедельным интервалом. Восстановление суставов колена данными препаратами может занять месяцы или годы, однако при своевременном начале лечения возможна полная регенерация разрушенных тканей.
Хондопротекторы представлены в продаже широким ассортиментом препаратов. Для получения высокого результата важно посоветоваться с врачом по поводу выбора лекарства. И их прием необходимо сочетать с другими рекомендованными терапевтическими методами.
Реабилитационные протоколы
Фаза иммобилизации (1-2 недели) с последующей постепенной активацией под контролем изокинетических тренажёров позволяет оптимизировать биомеханические нагрузки на регенерируемую ткань. Немецкие клиники внедряют роботизированные системы CPM (Continuous Passive Motion), увеличивающие диапазон движений на 15-20° за 4 недели. Комплексная физиотерапия с акцентом на квадрицепс снижает риск рецидивов на 30%.
Прогноз и ограничения методов
Долгосрочные исследования (10-15 лет) показывают, что 60% пациентов после ACI сохраняют функциональность сустава без прогрессирования артроза. Однако методы неприменимы при III-IV стадиях остеоартроза по Kellgren-Lawrence, где эффективность не превышает 20%. В таких случаях рекомендовано эндопротезирование с 95% 10-летней выживаемостью имплантов.
Заключение
Современные методы регенерации хряща коленного сустава позволяют эффективно восстанавливать локальные дефекты у 75-80% пациентов, откладывая необходимость эндопротезирования на 8-10 лет. Перспективы связаны с разработкой биосовместимых матриц, сочетающих стволовые клетки и цитокины направленного действия. Клинические испытания фазы III препарата Invossa (TG-C) на основе трансфицированных хондроцитов демонстрируют увеличение синтеза протеогликанов на 40% in vivo, что может революционизировать лечение остеоартроза в следующем десятилетии.